骨髓间充质干细胞新功能——其胞葬通过线粒体重塑破坏成骨细胞分化

有效清除死亡和濒死细胞,即胞葬,对于维持组织稳态至关重要。在骨髓微环境(BMME)中,这一作用主要由专职骨髓巨噬细胞完成,但最近的研究表明,间充质基质细胞(MSCs)在BMME中扮演非专职吞噬细胞的角色。然而,关于胞葬对间充质干细胞及其功能的机制和影响知之甚少。本研究描述了间充质干细胞作为BMME中的非专业吞噬细胞的新功能,并证明了间充质干细胞的胞葬作用在指导线粒体重塑和间充质干细胞分化中起关键作用。该研究于2023年7月发表在《Cell Death & Disease》,IF:9.0。
技术路线
主要研究结果
1. 间充质基质细胞参与胞葬
为研究胞化对间充质干细胞的影响,首先用流式细胞术分析ST2细胞(小鼠骨髓来源的间充质基质细胞系)对中性粒细胞的摄取。该检测表明,ST2细胞对终末期小鼠中性粒细胞(PMNs)进行胞外吞噬(图1A、B)。通过显微镜检查证实ST2主动吞噬终末期PMNs,细胞质中遗留的空隙和z-堆栈成像证明了这一点(图1C、D)。综上所述,这些数据证实间充质干细胞可以积极参与胞葬,但胞葬后对间充质干细胞支持正常功能的能力的影响仍有待阐明。
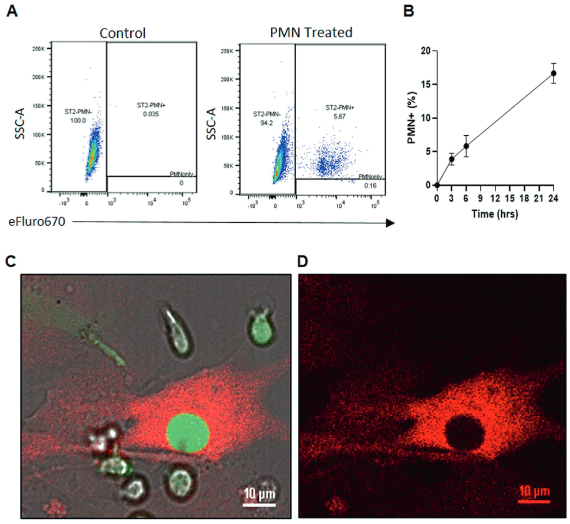
图1. 间充质干细胞可进行胞葬
为确定MSCs利用的胞浆机制,对暴露于过量人PMNs(1:10)的ST2细胞进行RNA测序。在加入PMNs后3和24小时收集细胞,根据目标标签的存在通过荧光激活细胞分选(FACS)分离(图2A)。
主成分分析显示,早期(3 h)和晚期(24 h)的胞葬细胞之间以及与非胞葬(对照)细胞之间的基因谱存在较大差异(图2B)。正如预期的那样,基于其进行胞葬的功能能力,MSCs甚至在胞葬攻击之前就表达许多吞噬和胞葬受体和信号通路的转录物(图2C)。值得注意的是,吞噬和胞葬受体在胞葬后3小时上调(Axl,Tyro3,Itagv等),而降解凋亡货物所需的内部处理途径所需的分子转录物(例如,Elmo1, Elmo2,Dock1,Gulp1)在24小时上调(图2C-E)。骨髓来源的原代小鼠MSCs也可以吞噬凋亡的胸腺细胞(图2F,G)。对暴露于凋亡胸腺细胞(SCAT)的原代小鼠骨髓来源的基质细胞进行转录分析,发现ST2细胞中相同的胞浆途径(图2H-J)。这些数据确定原代小鼠间充质干细胞的关键胞浆介质,并提示无论凋亡靶点如何,类似的机制都被使用。

图2. MSCs上调胞葬受体通路
2. MSCs胞葬诱导应激反应
应用基因集富集分析(GSEA)和KEGG数据库的通路分析预测胞葬对MSCs的功能影响。与胞葬行为一致,有转录证据表明参与吞噬体和溶酶体的基因增加(图3A、B)。此外,该分析确定通过转录下调的代谢和生物发生途径(图3C、D)以及参与细胞衰老和凋亡的基因上调(图3E、F)的MSC整体应激的证据。为从功能上证实通过通路分析确定的细胞衰老,测定胞浆ST2细胞中β-半乳糖苷酶(β-Gal)和增殖潜能。与非胞葬(PMN-) ST2细胞相比,胞葬(PMN+) ST2细胞的β-Gal活性增加(图3G)。与细胞衰老增加一致,分选的PMN + ST2细胞的细胞复制减少(图3H)。因此,这些数据表明胞葬诱导MSCs显著的细胞应激。
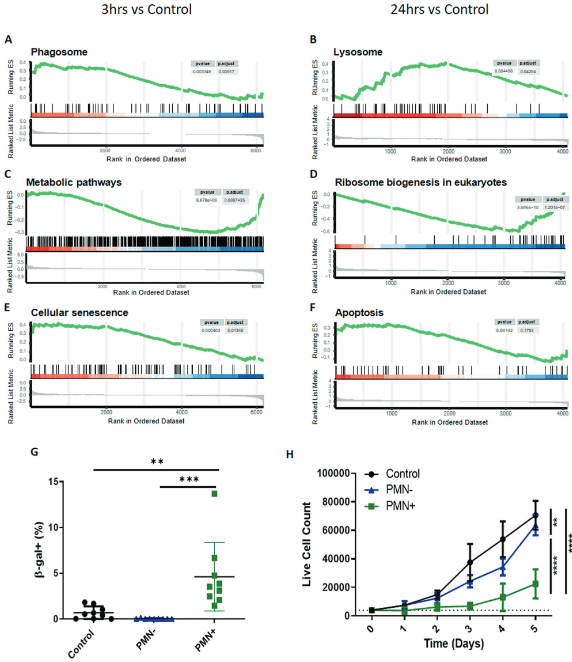
图3. MSCs的胞葬降低代谢基因的表达,增加应激反应基因的表达
3. 间充质基质细胞胞葬破坏成骨细胞和脂肪细胞分化能力
为测试胞葬对间充质干细胞分化的影响,用胞葬靶点诱导间充质干细胞向成骨细胞和脂肪细胞分化。将ST2细胞以ST2:PMN的比例为1:1,1:2和1:3暴露于PMN中24小时,在去除未被吞噬的PMN后,将ST2细胞暴露于成骨诱导或脂肪诱导的培养基中。尽管在之前的实验中,24小时只有一部分ST2细胞为PMN+(见图1B),但通过碱性磷酸酶和Von Kossa染色,与未暴露于PMN的ST2细胞相比,暴露于PMN的ST2细胞降低了成骨细胞分化(图4A ~ D)。通过FACS分离PMN+和PMN- ST2细胞(图4E)。发现与对照组相比,有胞葬细胞的MSCs (PMN+)的碱性磷酸酶染色减少,而其非胞葬细胞(PMN -)的MSCs的碱性磷酸酶染色令人惊讶地有小幅但显著的增加,对照组也接受未分离的FACS流体(图4E-G)。因此,间充质干细胞的胞葬作用在间充质干细胞成骨分化中诱导细胞自主缺陷。与成骨的功能缺陷相一致,胞葬后,正性成骨调节基因如Osr1、Bmp4、Omd、Igf-1减少,而负性成骨调节基因如Suv39h1增加(图4H,红色突出的特定基因)。与成骨抑制相似,胞葬的间充质干细胞如诱导后脂质空泡形成减少所示,脂肪细胞分化减少(图5A-F)。与脂肪生成中的功能缺陷一致,阳性的脂肪生成调节基因,如Cebpa, Cebpg, Srebf1和Fosb在胞葬后减少(图5G,红色突出显示的特定基因)。综上所述,这些数据表明胞葬作用通过抑制间充质干细胞分化而破坏间充质干细胞的分化能力,而不是通过从成骨细胞向脂肪细胞分化。

图4. 终末期中性粒细胞胞葬破坏成骨细胞分化
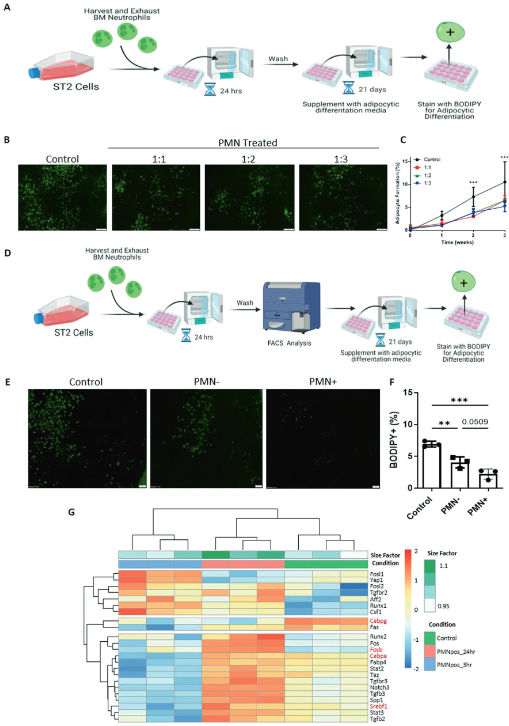
图5. 终末期中性粒细胞胞葬破坏脂肪细胞分化
4. 间充质干细胞的胞葬破坏代谢和线粒体网络
在胞葬MSCs的转录过程中发现的许多通路与代谢失调相关(图3C、D)。测定氧消耗率(OCR)和细胞外酸化率(ECR),这两项分别测定氧化磷酸化和糖酵解。与转录数据一致,MSCs的胞葬减少氧化磷酸化(图6A、B)和糖酵解(图6C、D)。分选PMN+和PMN- MSCs,并测定OCR和ECR,发现在氧耗和糖酵解方面,最剧烈的代谢紊乱出现在胞葬型(PMN+) MSCs中,而非胞葬型(PMN -) MSCs的糖酵解相对保留(图6E-H)。这些数据表明胞葬显著改变间充质干细胞的代谢过程。
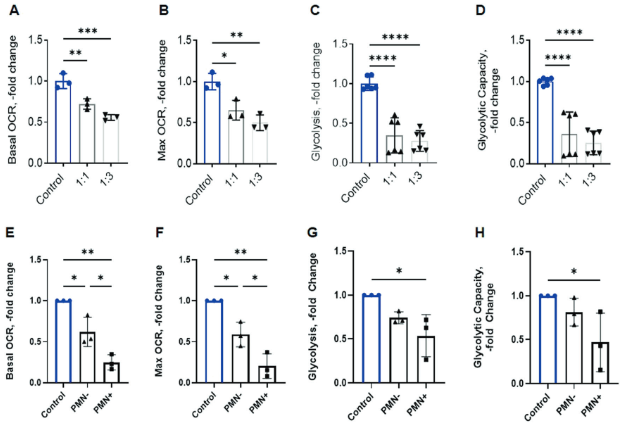
图6. 胞葬MSCs的氧化磷酸化和糖酵解被破坏
5. 抑制线粒体分裂减少胞葬并挽救成骨细胞分化障碍
利用ST2 RNA测序数据集探索线粒体动力学基因和通路,发现胞葬介导的基因动态调节与线粒体分裂和融合有关。在胞葬过程的早期(3小时),间充质干细胞上调融合基因,如Mfn2和Opa1(图7A,蓝色标记),然而随着胞葬过程的进行(24小时),间充质干细胞上调分裂基因,如Fis1和Dmnl1(图7A,红色标记)。这些数据表明,MSCs在进行胞葬后,从线粒体融合状态转变为分裂状态。为证实胞葬MSCs的线粒体重塑,使用MitoTracker Red或TMRE标记对照组和PMN+ MSCs的线粒体,并分别评估线粒体长度和膜电位。发现胞葬MSCs的线粒体长度(图7B、C)和TMRE信号(图7D)降低,与线粒体发生分裂相一致。综上所述,这些数据表明,由于胞葬,MSCs的氧化功能降低,线粒体发生重塑,这与线粒体发生分裂的情况一致。
测试从人骨髓分离的MSCs是具有胞浆功能。人骨髓间充质干细胞(hMSCs)表现出与小鼠骨髓间充质干细胞相似的胞葬率(图7E、F)。与对小鼠骨髓间充质干细胞的影响相似,胞葬也抑制hMSCs向成骨细胞的分化(图7K)。在胞葬前用Mdivi(线粒体分裂的抑制剂)处理hMSCs。在使用Mdivi预处理的hMSCs中,在24小时检测的胞葬的总体速率和效率(MFI)降低,但不影响其活力(图7G-J)。与线粒体重塑在MSC向成骨细胞分化中的作用一致,在没有PMN的情况下,Mdivi处理有增加成骨细胞分化的趋势(图7K)。重要的是,Mdivi和PMN共同处理可恢复hMSCs的成骨分化潜能(图7K)。综上所述,在MSC胞葬过程中抑制线粒体分裂可以挽救胞葬MSC的成骨分化潜能。这些数据表明,在MSCs中,线粒体分裂的增加介导胞葬诱导的成骨细胞分化缺陷。
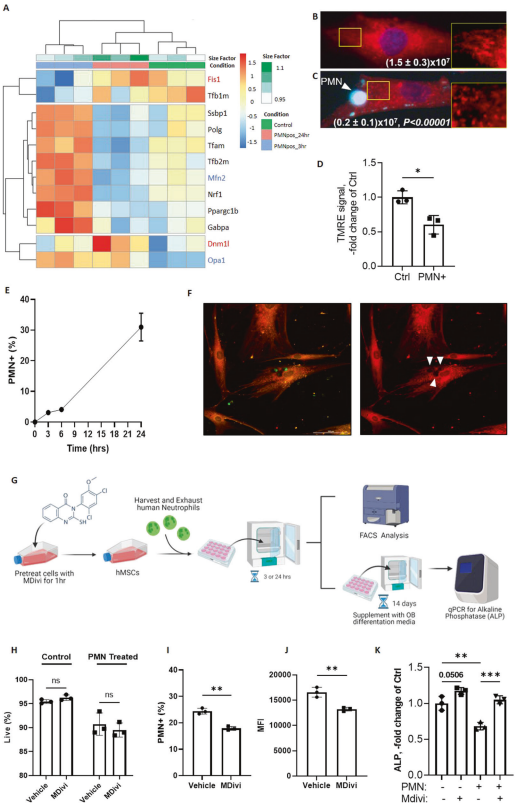
图7. 胞葬使MSC线粒体趋向分裂
结论
本研究描述了间充质干细胞作为BMME中的非专业吞噬细胞的新功能,并证明了间充质干细胞的胞葬作用在指导线粒体重塑和间充质干细胞分化中起关键作用。因此,MSCs的胞葬功能可能是一种功能障碍和衰老的新机制。由于人类间充质干细胞的数据表明,间充质干细胞胞葬是保守的,因此,MSC胞葬的结果可能会影响这些细胞在人类骨骼中的行为,包括在衰老、癌症和其他疾病背景下的骨髓重塑和骨丢失。
实验方法
体外胞葬分析,共聚焦显微技术,RNA 测序,生物能量学分析,线粒体网络测量,线粒体膜电位测量,分化实验,BODIPY染色,碱性磷酸酶和Von Kossa染色,光显微镜,药物抑制线粒体分裂的胞葬分析,药物抑制线粒体分裂的碱性磷酸酶测定,流式细胞术
参考文献
Quarato ER, Salama NA, Li AJ, Smith CO, Zhang J, Kawano Y, McArthur M, Liesveld JL, Becker MW, Elliott MR, Eliseev RA, Calvi LM. Efferocytosis by bone marrow mesenchymal stromal cells disrupts osteoblastic differentiation via mitochondrial remodeling. Cell Death Dis. 2023 Jul 14;14(7):428. doi: 10.1038/s41419-023-05931-9. PMID: 37452070; PMCID: PMC10349065.






